我校基礎醫(yī)學院張春林,、馮建團隊的青年教師何美娜主導完成的研究論文“Black Phosphorus Nanosheets Protect Neurons by Degrading Aggregative α-syn and Clearing ROS in Parkinson's Disease”,,近日發(fā)表于材料學國際頂級期刊Advanced Materials(IF:29.4)。該研究報道了黑磷納米片降解α-syn蛋白聚集,、清除ROS保護神經(jīng)細胞改善帕金森病的機制,。

帕金森病(PD)是中老年人中第二常見的神經(jīng)退行性疾病,。其主要病理表現(xiàn)為黑質(zhì)多巴胺(DA)能神經(jīng)元變性,、壞死和錯誤折疊α-突觸核蛋白(α-syn)聚集形成路易小體。目前,,PD的藥物治療策略主要集中在補充DA能神經(jīng)元變性,、壞死引發(fā)的多巴胺分泌不夠,緩解臨床癥狀,,但該策略不會延緩疾病的進展,,并存在副作用。因此,迫切需要開發(fā)新的策略來提高PD治療的特異性和療效,。
α-syn錯誤折疊和聚集是帕金森病的主要致病事件,。過表達、基因突變都會造成α-syn蛋白異常聚集,,形成神經(jīng)毒性的α-syn纖維,。聚集的α-syn纖維可誘導線粒體功能障礙,促進活性氧(ROS)的產(chǎn)生,,擾亂泛素蛋白酶體,、自噬等降解系統(tǒng),從而導致多巴胺神經(jīng)元死亡,。反之,,線粒體的損傷、ROS的產(chǎn)生,、降解系統(tǒng)障礙又會促進α-syn蛋白的聚集,。這兩個過程形成了惡性循環(huán),加劇多巴胺能神經(jīng)元的功能喪失,。因此,,α-syn聚集、ROS過載是干預PD的一個重要靶點,。
該團隊發(fā)現(xiàn)新型二維納米材料-黑磷納米片(BPNSs),,可有效地穿過血腦屏障(BBB),保護多巴胺能神經(jīng)元,,改善PD癥狀,,但其作用機制不清楚。進一步的機制研究利用多種模型,,諸如α-syn體外共培養(yǎng)模型,、多種PD細胞模型、線蟲模型和PD轉(zhuǎn)基因小鼠模型,,探究BPNSs對PD神經(jīng)保護作用的細胞,、分子機制。首先在體外模型中發(fā)現(xiàn)BPNSs可以直接結(jié)合α-syn纖維,,并通過范德華力觸發(fā)其降解,。其次,BPNSs可激活自噬,,降解α-syn聚集蛋白,,維持α-syn穩(wěn)態(tài)。此外,,BPNSs還可以顯著改善線粒體功能障礙,,降低胞質(zhì),、線粒體內(nèi)ROS水平,挽救神經(jīng)元死亡和突觸喪失,。最后,,在MPTP誘導的PD小鼠模型和hA53T α-syn轉(zhuǎn)基因PD小鼠中觀察到BPNSs穿透血腦屏障,阻止多巴胺神經(jīng)元的丟失,,減輕DA依賴的行為障礙,。總之,,該研究表明BPNSs具有作為PD臨床治療的新型納米藥物的潛力,。
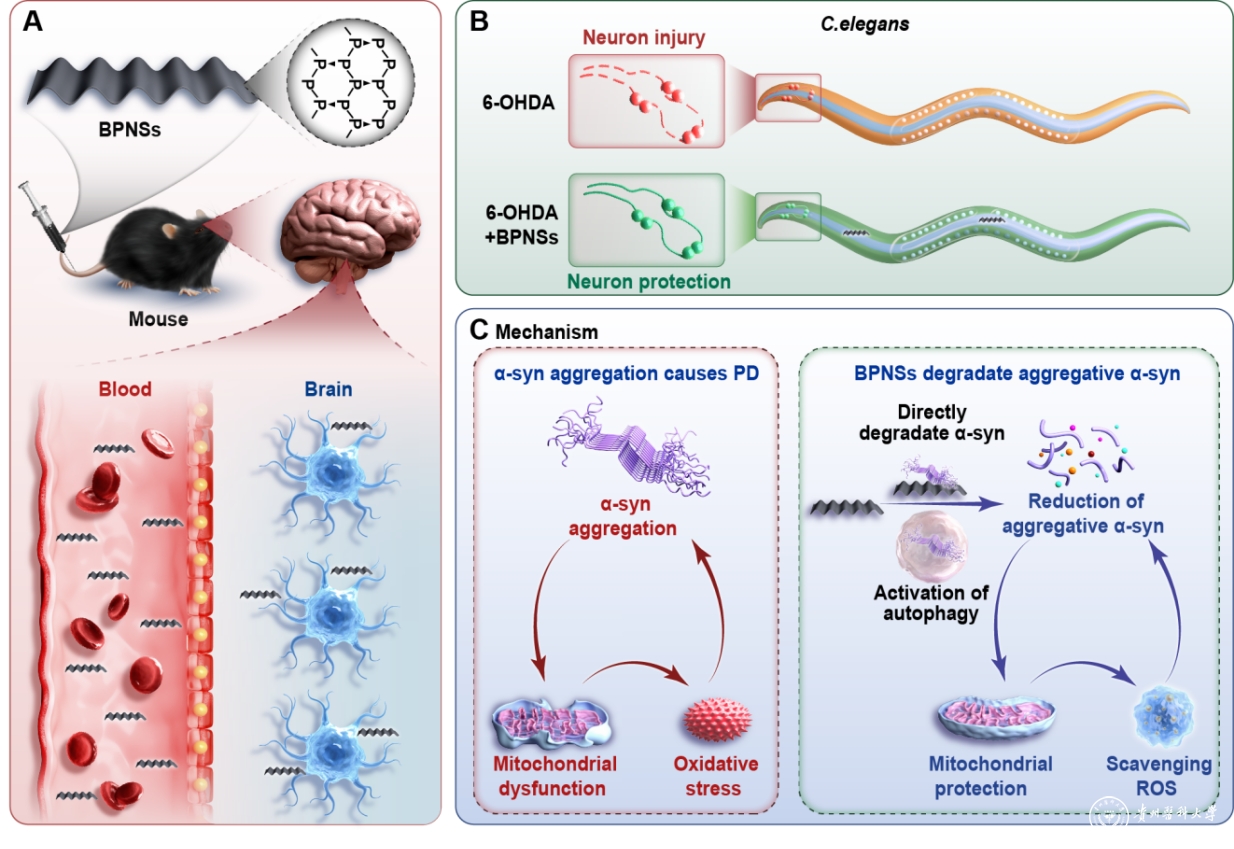
圖示BPNSs在細胞、線蟲和小鼠帕金森病模型中的神經(jīng)保護作用示意圖
A.BPNSs穿過血腦屏障示意圖,。B.BPNSs在線蟲模型中的神經(jīng)保護作用,。C.BPNSs降解α-syn聚集以及清除ROS保護神經(jīng)細胞改善帕金森疾病的分子機制。
基礎醫(yī)學院張春林教授和馮建教授為該文章的共同通訊作者,,基礎醫(yī)學院何美娜副教授,、在讀博士研究生張祥明、冉霞講師為文章的并列第一作者,?;A醫(yī)學院多名師生參與該研究。我校分子醫(yī)學工程研究中心和基礎醫(yī)學科學研究中心提供了儀器和技術(shù)支持,。該研究受多項國家自然科學基金資助,,也是學校近年來圍繞“雙一流”內(nèi)涵建設,持續(xù)完善創(chuàng)新團隊和優(yōu)秀青年科技人才政策體系的成果之一,。
何美娜博士是學校引進的博士青年人才,,入選學校優(yōu)秀青年人才培養(yǎng)計劃。主要研究方向為卵巢功能早衰,、帕金森病的機制及靶向治療。先后承擔國家自然科學基金青年基金,、地區(qū)基金,、中國博士后面上基金及省科技廳項目等;在Science Bulletin(IF:18.9,,中科院一區(qū)),、Cell death and disease(IF:9.0,中科院一區(qū)),、Aging cell(IF:7.8,,中科院一區(qū))、Cellular And Molecular Life Sciences(CMLS)(IF:8.7,,中科院二區(qū))等學術(shù)期刊上發(fā)表多篇研究論文,;授權(quán)國家發(fā)明專利1項,。
原文鏈接:http://www.ncbi.nlm.nih.gov/pubmed/38696266
 公網(wǎng)安備 52010302000012號
公網(wǎng)安備 52010302000012號